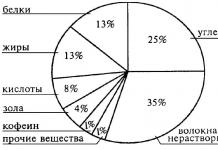
Очень много различных вещей и предметов, живых и неживых тел природы нас окружает. И все они имеют свой состав, строение, свойства. В живых существах протекают сложнейшие биохимические реакции, сопровождающие процессы жизнедеятельности. Неживые тела выполняют различные функции в природе и жизни биомассы и имеют сложный молекулярный и атомарный состав.
Но все вместе объекты планеты имеют общую особенность: они состоят из множества мельчайших структурных частиц, называемых атомами химических элементов. Настолько мелких, что невооруженным взглядом их не рассмотреть. Что такое химические элементы? Какими характеристиками они обладают и откуда стало известно об их существовании? Попробуем разобраться.
Понятие о химических элементах
В общепринятом понимании химические элементы - это лишь графическое отображение атомов. Частиц, из которых складывается все существующее во Вселенной. То есть на вопрос "что такое химические элементы" можно дать такой ответ. Это сложные маленькие структуры, совокупности всех изотопов атомов, объединенные общим названием, имеющие свое графическое обозначение (символ).
На сегодняшний день известно о 118 элементах, которые открыты как в естественных условиях, так и синтетически, путем осуществления ядерных реакций и ядер других атомов. Каждый из них имеет набор характеристик, свое местоположение в общей системе, историю открытия и название, а также выполняет определенную роль в природе и жизни живых существ. Изучением этих особенностей занимается наука химия. Химические элементы - это основа для построения молекул, простых и сложных соединений, а следовательно, химических взаимодействий.
История открытия
Само понимание того, что такое химические элементы, пришло только в XVII веке благодаря работам Бойля. Именно он впервые заговорил об этом понятии и дал ему следующее определение. Это неделимые маленькие простые вещества, из которых складывается все вокруг, в том числе и все сложные.
До этой работы господствовали взгляды алхимиков, признававшим теорию четырех стихий - Эмпидокла и Аристотеля, а также открывших "горючие начала" (сера) и "металлические начала" (ртуть).
Практически весь XVIII век была распространена совершенно ошибочная теория флогистона. Однако уже в конце этого периода Антуан Лоран Лавуазье доказывает, что она несостоятельна. Он повторяет формулировку Бойля, но при этом дополняет ее первой попыткой систематизации всех известных на тот момент элементов, распределив их на четыре группы: металлы, радикалы, земли, неметаллы.

Следующий большой шаг в понимании того, что такое химические элементы, делает Дальтон. Ему принадлежит заслуга открытия атомной массы. На основе этого он распределяет часть известных химических элементов в порядке возрастания их атомной массы.
Стабильно интенсивное развитие науки и техники позволяет делать ряд открытий новых элементов в составе природных тел. Поэтому к 1869 году - времени великого творения Д. И. Менделеева - науке стало известно о существовании 63 элементов. Работа русского ученого стала первой полной и навсегда закрепившейся классификацией этих частиц.
Строение химических элементов на тот момент установлено не было. Считалось, что атом неделим, что это мельчайшая единица. С открытием явления радиоактивности было доказано, что он делится на структурные части. Практически каждый при этом существует в форме нескольких природных изотопов (аналогичных частиц, но с иным количеством структур нейтронов, от чего меняется атомная масса). Таким образом, к середине прошлого столетия удалось добиться порядка в определении понятия химического элемента.
Система химических элементов Менделеева
В основу ученый положил различие в атомной массе и сумел гениальным образом расположить все известные химические элементы в порядке ее возрастания. Однако вся глубина и гениальность его научного мышления и предвидения заключалась в том, что Менделеев оставил пустые места в своей системе, открытые ячейки для еще неизвестных элементов, которые, по мнению ученого, в будущем будут открыты.
И все получилось именно так, как он сказал. Химические элементы Менделеева с течением времени заполнили все пустые ячейки. Была открыта каждая предсказанная ученым структура. И теперь мы можем смело говорить о том, что система химических элементов представлена 118 единицами. Правда, три последних открытия пока еще официально не подтверждены.
Сама по себе система химических элементов отображается графически таблицей, в которой элементы располагаются согласно иерархичности их свойств, зарядам ядер и особенностям строения электронных оболочек их атомов. Так, имеются периоды (7 штук) - горизонтальные ряды, группы (8 штук) - вертикальные, подгруппы (главная и побочная в пределах каждой группы). Чаще всего отдельно в нижние слои таблицы выносятся два ряда семейств - лантаноиды и актиноиды.

Атомная масса элемента складывается из протонов и нейтронов, совокупность которым имеет название "массовое число". Количество протонов определяется очень просто - оно равно порядковому номеру элемента в системе. А так как атом в целом - система электронейтральная, то есть не имеющая вообще никакого заряда, то количество отрицательных электронов всегда равно количеству положительных частиц протонов.
Таким образом, характеристика химического элемента может быть дана по его положению в периодической системе. Ведь в ячейке описано практически все: порядковый номер, а значит, электроны и протоны, атомная масса (усредненное значение всех существующих изотопов данного элемента). Видно, в каком периоде находится структура (значит, на стольких слоях будут располагаться электроны). Также можно предсказать количество отрицательных частиц на последнем энергетическом уровне для элементов главных подгрупп - оно равно номеру группы, в которой располагается элемент.

Количество нейтронов можно рассчитать, если вычесть из массового числа протоны, то есть порядковый номер. Таким образом, можно получить и составить целую электронно-графическую формулу для каждого химического элемента, которая будет в точности отражать его строение и показывать возможные и проявляемые свойства.
Распространение элементов в природе
Изучением этого вопроса занимается целая наука - космохимия. Данные показывают, что распределение элементов по нашей планете повторяет такие же закономерности во Вселенной. Главным источником ядер легких, тяжелых и средних атомов являются ядерные реакции, происходящие в недрах звезд - нуклеосинтез. Благодаря этим процессам Вселенная и космическое пространство снабдили нашу планету всеми имеющимися химическими элементами.
Всего из известных 118 представителей в естественных природных источниках людьми были обнаружены 89. Это основополагающие, самые распространенные атомы. Химические элементы также были синтезированы искусственно, путем бомбардировки ядер нейтронами (нуклеосинтез в лабораторных условиях).

Самыми многочисленными считаются простые вещества таких элементов, как азот, кислород, водород. Углерод входит в состав всех органических веществ, а значит, также занимает лидирующие позиции.
Классификация по электронному строению атомов
Одна из самых распространенных классификаций всех химических элементов системы - это распределение их на основе электронного строения. По тому, сколько энергетических уровней входит в состав оболочки атома и который из них содержит последние валентные электроны, можно выделить четыре группы элементов.
S-элементы
Это такие, у которых последней заполняется s-орбиталь. К этому семейству относятся элементы первой группы главной подгруппы (или Всего один электрон на внешнем уровне определяет схожие свойства этих представителей как сильных восстановителей.
Р-элементы
Всего 30 штук. Валентные электроны располагаются на р-подуровне. Это элементы, формирующие главные подгруппы с третьей по восьмую группу, относящиеся к 3,4,5,6 периодам. Среди них по свойствам встречаются как металлы, так и типичные неметаллические элементы.
d-элементы и f-элементы
Это переходные металлы с 4 по 7 большой период. Всего 32 элемента. Простые вещества могут проявлять как кислотные, так и основные свойства (окислительные и восстановительные). Также амфотерные, то есть двойственные.
К f-семейству относятся лантаноиды и актиноиды, у которых последние электроны располагаются на f-орбиталях.
Вещества, образуемые элементами: простые
Также все классы химических элементов способны существовать в виде простых или сложных соединений. Так, простыми принято считать такие, которые образованы из одной и той же структуры в разном количестве. Например, О 2 - кислород или дикислород, а О 3 - озон. Такое явление носит название аллотропии.

Простые химические элементы, формирующие одноименные соединения, характерны для каждого представителя периодической системы. Но не все они одинаковы по проявляемым свойствам. Так, существуют простые вещества металлы и неметаллы. Первые образуют главные подгруппы с 1-3 группу и все побочные подгруппы в таблице. Неметаллы же формируют главные подгруппы 4-7 групп. В восьмую основную входят особые элементы - благородные или инертные газы.
Среди всех открытых на сегодня простых элементов известны при обычных условиях 11 газов, 2 жидких вещества (бром и ртуть), все остальные - твердые.
Сложные соединения
К таковым принято относить все, которые состоят из двух и более химических элементов. Примеров масса, ведь химических соединений известно более 2 миллионов! Это соли, оксиды, основания и кислоты, сложные комплексные соединения, все органические вещества.
Химические элементы - см. Элементы, Вес атомов, Периодическая законность, Химия и Лавуазье … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Синтезированные химические элементы - Синтезированные (искусственные) химические элементы элементы, впервые идентифицированные как продукт искусственного синтеза. Часть из них (тяжёлые трансурановые элементы, все трансактиноиды), по видимому, отсутствует в природе; другие… … Википедия
ЭЛЕМЕНТЫ-ПРИМЕСИ - химические элементы, присутствующие в минералах других элементов в виде изоморфных примесей или тонких механических включений; иногда извлекаются в качестве попутных или даже основных (напр., золото из пирита) компонентов. В число элементов… … Большой Энциклопедический словарь
ХИМИЧЕСКИЕ ВЕЩЕСТВА - химические элементы и соединения, их смеси, как натуральные, так и искусственные, а также готовые изделия, содержащие в своем составе Х. в., способные оказать вредное воздействие на человека при нормальных или непредсказуемых условиях их… … Российская энциклопедия по охране труда
элементы петрогенные - Главнейшие химические элементы, образующие горные породы; к ним относятся наиболее распространенные элементы земной коры (O, Si, Al, Fe, Ca, Mg, К и др). [Словарь геологических терминов и понятий. Томский Государственный Университет] Тематики… … Справочник технического переводчика
ЭЛЕМЕНТЫ БИОФИЛЬНЫЕ - поглощаемые из геохим. среды (почвы, воды) организмами и используемые в процессах жизнедеятельности. К ним относятся: макроэлементы N, С, О, Н, Са, Mg, Na, К, Р, S, Cl, Si, Fe и микроэлементы Сu, Со, Mn, Zn, V, Ni, Mo, Sr, В, Se, F, Br, I. Кроме… … Геологическая энциклопедия
Элементы зольные - химические элементы, входящие в состав золы растений и животных. Обычно это все элементы, которые могут находиться в растениях и животных, кроме углерода, водорода, кислорода и азота; последние не входят в состав золы, так как улетучиваются при… … Толковый словарь по почвоведению
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ - простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Элементы химические - Периодическая система химических элементов Д. И. Менделеева H … Википедия
элементы-примеси - химические элементы, присутствующие в минералах других элементов в виде изоморфных примесей или тонких механических включений; иногда извлекаются в качестве попутных или даже основных (например, золото из пирита) компонентов. В число элементов… … Энциклопедический словарь
Книги
- Химические элементы , Вайткене Любовь Дмитриевна , Fe, Au, Cu Феррум, аурум, купрум Ты еще не знаешь, что означают эти слова, но очень хотел бы узнать? Тогда эта книга твой верный помощник в освоении такой непростой науки, как химия.… Категория: Разное Серия: Для самых любознательных Издатель: АСТ , Производитель: АСТ , Купить за 987 грн (только Украина)
- Химические элементы , Вайткене , Любовь Дмитриевна , Fе, Au, Cu ... Феррум, аурум, купрум... Ты еще не знаешь, что означают эти слова, но очень хотел бы узнать? Тогда эта книга - твой верный помощник в освоении такой непростой науки, как… Категория:
Занимает всего один листок, но в этом листке заключено огромное количество информации. В каждой клетке таблицы расположены международный символ элемента, его название (в наших таблицах – на русском языке), его порядковый номер, относительная атомная масса (для нестабильных элементов – массовое число). Как правило, цветом выделена принадлежность элементов к тому или иному семейству, а также дано строение электронных оболочек атомов. Некоторые фирмы выпускают красочные таблицы, в которых в каждой клетке помещена фотография соответствующего простого вещества, дано строение наиболее устойчивой кристаллической решетки, даны сведения о применении данного элемента. Интересно решается оформление клеточек с радиоактивными элементами. Так, в одной таблице на месте радия помещена фотография рабочего журнала Марии Кюри , открытого на той странице, где впервые появилась запись об открытии нового элемента.
Оригинальную серию из пятнадцати цветных открыток выпустила ассоциация французских химиков. На ней помещены фотографии почтовых марок, выпущенных во многих странах мира. Каждая марка посвящена очередному химическому элементу. И, конечно, почетное место занимает портрет создателя периодической системы элементов – Д.И.Менделеева и фотография первого рукописного наброска его таблицы. На марках – портреты ученых, открывших элементы, минералы, из которых эти элементы добывают, их кристаллические решетки, структурные формулы соединений... А когда владельцу этой филателистической коллекции профессору химии из университета Дижона Жану Тируфле не удавалось найти подходящую марку, он остроумно выходил из положения, прибегая к иносказанию. Так, на месте галлия помещена французская марка с поющим петушком. И это неспроста. Элемент галлий был предсказан Менделеевым (как эка-алюминий) и открыт в 1875 французским химиком Полем Эмилем Лекок де Буабодраном (P.E. Lecoq de Boisbaudran), который назвал его в честь своей родины (Gallia – латинское название Франции). Символ Франции – петух (по-французски – le coq), так что в названии элемента его первооткрыватель неявно увековечил и свою фамилию!
Еще Менделеев говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16-томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»...
Сейчас мало кому известны имена тех, кто предложил современную шкалу атомных масс, впервые разделил мифический элемент «дидим» на празеодим и неодим, синтезировал технеций и нашел его следы в земной коре, – словом, всех, кто своим трудом внес хотя бы небольшой вклад в таблицу элементов. Но таблица – перед нами, и количество информации, которое она содержит – огромно. Начало же ее простирается вглубь веков, в античные времена, когда греческим философом Левкиппом и его знаменитым учеником Демокритом были сформулированы первые идеи об атомах.
Латинское слово элемент (elementum ) использовалось еще античными авторами (Цицерон , Овидий , Гораций), причем во многом в том же смысле, что и современное его значение – как часть чего-то (элемент речи, элемент образования и т.п.). Интересно происхождение названия этого слова. В древности было распространено изречение «Как слова состоят из букв, так и тела – из элементов». Отсюда – вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» – «em» – «en» – «tum»).
Близким по смыслу было у римлян слово principium в значении «составная часть», «начало». Древнеримский философ Тит Лукреций Кар в своей поэме О природе вещей часто употреблял термин principium (в переводе – «первоначало»). В этом смысле он очень близок современному «химическому» понятию элемента:
Что же до первоначал, то они еще больше имеют
Средств для того, чтоб из них возникали различные вещи,
Нет ни одной из вещей, доступных для нашего взора,
Чтоб она из начал состояла вполне однородных...
Первоначала вещей уносятся собственным весом
Или толчками других...
(О природе вещей. Тит Лукреций Кар)
Учение о том, что все вещества состоят из мельчайших частиц, получило название атомистической теории. Догадки древних, основанные лишь на размышлении, не так уж далеки, в принципе, от современных представлений: существует ограниченное число различных типов атомов (т.е. элементов), которые могут по-разному соединяться друг с другом, давая огромное разнообразие веществ с разными свойствами. А процесс перестройки взаимного расположения атомов составляет сущность химической реакции. Понятие об атомах, элементах – величайшее достижение человеческого разума. Очень образно об этом сказал лауреат Нобелевской премии по физике Ричард Фейнман : «Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это – атомная гипотеза (можно называть ее не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе... содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Атомы одного сорта составляют химический элемент. Еще в 17 в. Роберт Бойль , а в следующем веке – М.В.Ломоносов и А.Л.Лавуазье ясно сформулировали понятие «элемент» как простое вещество, которое невозможно разложить на составные части химическими методами. Современное определение химического элемента очень лаконичное: элемент – это совокупность атомов с определенным зарядом ядра Z . Заряд ядра равен числу протонов в нем; именно оно определяет сущность химического элемента, его индивидуальность и отличие от всех других элементов. Поэтому следует признать, что и бесцветный легкий газ, состоящий из молекул Н 2 и положительно заряженные катионы H + в водных растворах кислот, и анионы H – в расплавах гидрида лития LiH, и протоны в физических ускорителях или в глубинах Солнца, и «холодные» нейтральные атомы Н в межзвездных пространствах – все это элемент водород (Z = 1). Более того, тяжелые разновидности водорода – дейтерий (D) и тритий (T), содержащие, помимо одного протона один или два нейтрона, а также искусственно полученные сверхтяжелые атомы 4 H и 5 H также относятся к элементу водороду.
Всего в природе найдено 90 различных элементов, и еще более 20 получено искусственно. В природе химические элементы входят в состав простых и сложных веществ. Простые вещества образованы атомами одного и того же химического элемента, тогда как сложные вещества содержат атомы двух и более элементов.
Очень образно о различии понятий элемента и простого вещества написал американский химик Александр Смит, автор одного из лучших учебников неорганический химии начала 20 в.: «Правильно будет, если мы будем говорить об элементе железе и об элементе сере в сернистом железе; но никогда химик не скажет, что это соединение содержит простые вещества: железо и серу. Если бы он это сказал, то мы бы поняли его так, что данный материал представляет собой не соединение, а смесь; мы стали бы ожидать, что одни части этого материала магнитны, подобно железу, а другие части имеют желтый цвет и растворяются в сероуглероде – чего в действительности нет».
Но и простые вещества, оказывается, не так «просты»: большинство элементов могут образовать несколько простых тел. По определению, данному в Химической энциклопедии, простое вещество – это форма существования химического элемента, отличающаяся числом атомов в молекулах (например, кислород О 2 и озон О 3), типом кристаллической решетки (например, модификации углерода – графит, алмаз, карбин) или другими свойствами. Так что в газообразном водороде при комнатной температуре содержатся два простых вещества – две разновидности водорода (ортоводород и параводород); они отличаются взаимным расположением спинов ядер (см . МОМЕНТЫ АТОМОВ И ЯДЕР) и водород можно разделить на два простых вещества, отличающиеся по своим физическим свойствам (например, теплоемкостями). И даже такие газы, как H 2 , D 2 , T 2 , HD, HT, DT, следует считать разными простыми веществами, поскольку каждый газ содержит атомы только одного элемента – водорода, а свойства их сильно различаются. Несколько простых веществ образуют молекулы О 2: две разновидности газообразного кислорода (их называют синглетным и триплетным, они различаются электронным строением и реакционной способностью), и по меньшей мере четыре (!) разновидности твердого кислорода (вообще, наличие нескольких кристаллических модификаций для одного элемента – скорее правило, чем исключение). А еще существует озон... Не удивительно, что число известных простых веществ во много раз превышает число известных элементов.
В русском языке для обозначения как элементов, так и простых веществ, как правило, используются одни и те же термины. Химиков это не очень затрудняет, так как по контексту почти всегда ясно, о чем идет речь. Так, говоря «медная монета», «выплавка меди из руд», «высокая электропроводность меди», всегда подразумевают металлическую медь – простое вещество. Говоря же о малом распространении меди в природе, имеют в виду вовсе не металл (самородная медь – исключительно редкий минерал), а элемент медь, атомы которого могут входить в различные минералы. Утверждая, что «медь занимает в периодической таблице место между никелем и цинком», химик также имеет в виду не кусочки металла в клетках таблицы, а элемент медь как совокупность ее атомов с зарядом ядра Z = 29.
Разные термины для элемента и образуемых им простых веществ встречаются редко. Кроме дейтерия и трития, следует упомянуть углерод. Углерод – «рождающий уголь», но это не сам уголь, а химический элемент. Углерод содержится в океанской воде и атмосфере, в теле человека и животных, во многих минералах. Стержень же карандаша и украшение на перстне изготовлены из простых веществ – графита и алмаза. Сейчас известны и другие простые вещества, образованные элементом углеродом – лонсдейлит, карбин, различные фуллерены , нанотрубки (фуллерены и нанотрубки часто объединяют под одним названием «фуллерит»).
Понятие простого вещества, как и многие другие основные понятия химии, отчасти условно. Ведь «железный» гвоздь сделан вовсе не из железа, а из низкоуглеродистой стали, содержащей небольшое количество углерода. Золотая монета содержит не менее 10% меди или серебра (чистое золото очень мягкое). И даже чистейший полупроводниковый кремний содержит ничтожные количества атомов других элементов. Число окружающих нас в быту относительно чистых простых веществ невелико: это алюминий и медь в проводах, вольфрам, молибден, криптон в электрических лампочках, водород и гелий в воздушных шариках, серебро, золото, платина, палладий в высокопробных ювелирных изделиях и монетах, ртуть в термометре, олово на консервной банке, хром и никель на металлических изделиях, сера для борьбы с вредителями растений, цинк в электрических батарейках...
Атомы (вернее ядра) любого химического элемента построены из целого числа простейших «кирпичиков» – ядер атомов водорода (протонов) и незаряженных нейтронов. Число протонов определяет, какому конкретно элементу принадлежит данное ядро. А вот число протонов в ядрах атомов данного элемента может быть разным (сумма протонов и нейтронов в ядре называется массовым числом). Разновидности атомов данного элемента, различающиеся числом нейтронов в ядре и, следовательно, массой, называются изотопами. Этот термин был предложен в 1910 английским химиком Фредериком Содди, который произвел его от греческих слов isos – равный, одинаковый и topos – место, т.е. занимающие одну и ту же клетку в периодической таблице. Разные изотопы данного элемента называют так же, как и сам элемент с прибавлением массового числа: хлор-35, хлор-37. Обозначают же изотопы символами соответствующего элемента с указанием вверху слева массового числа: 35 Cl, 37 Cl и т.д. Конкретное же ядро (или атом) с определенным значением массового числа называется нуклидом (от латинского nucleus – ядро). Поэтому правильным будет такое утверждение: природный хлор представлен двумя изотопами, кислород – тремя (нуклиды 16 О, 17 О и 18 О), сера – четырьмя, титан – пятью, кальций – шестью, молибден – семью, кадмий – восемью, ксенон – девятью, а рекорд принадлежит олову – оно имеет десять изотопов (нуклиды от 112 Sn до 124 Sn за исключением 113 Sn, 121 Sn и 123 Sn. Некоторые элементы в природе представлены лишь одним нуклидом – это 9 Be, 19 F, 23 Na, 27 Al, 31 P, 45 Sc, 59 Co, 75 As, 89 Y, 93 Nb, 103 Rh, 127 I, 133 Cs, 141 Pr, 159 Tb, 165 Ho, 169 Tm, 197 Au, 209 Bi (приведены лишь стабильные, то есть нерадиоактивные нуклиды). Обращает на себя внимание, что все так называемые «элементы-одиночки» представлены нуклидами с нечетным массовым числом.
Во времена Содди изотопами называли различные радиоактивные разновидности атомов данного элемента. При этом принадлежность конкретного нуклида данному элементу часто была неизвестна, и многие из них имели свои названия, например, RaA (нуклид 218 Po), RaB (214 Pb), RaC (214 Bi), RaC" (214 Po), RaC"" (210 Tl), RaD (210 Pb), RaE (210 Bi), два «мезотория»: MsTh 1 (нуклид 228 Ra) и MsTh 2 (нуклид 228 Ac) «радиоторий» RdTh (нуклид 228 Th), газообразные изотопы радона – «эманации» (от латинского emanatio – истечение): эманация радия RaEm (нуклид 222 Rn), актиния AcEm (нуклид 219 Rn) и тория ThEm (нуклид 220 Rn) и т.д. Некоторые из этих названий до сих пор иногда используются в радиохимии. В настоящее время разные названия общеприняты только для изотопов водорода – протий (1 Н), дейтерий (2 Н или D), тритий (3 Н или Т). Происходит это потому, что водород – один из важнейших элементов, а разные его изотопы очень сильно – в несколько раз – различаются по массе и потому имеют не только разные физические свойства, но и различную реакционную способность. Например, дейтерий и его соединения обычно обладают меньшей реакционной способностью и реагируют медленнее, чем легкий изотоп (кинетический изотопный эффект). В настоящее время известно около 280 стабильных и более 2000 радиоактивных изотопов химических элементов.
Илья Леенсон
Инструкция
Лавуазье отнес к элементам ряд простых веществ – все известные к тому времени металлы, а также фосфор, серу, водород, кислород, азот. Помимо этого, он отнес к элементам свет, теплород и. «солеобразующие землистые вещества». Разумеется, с позиции сегодняшнего дня, многие его утверждения кажутся наивными, но для того времени это был большой шаг вперед.
В первой половине 10-го века, усилиями Дальтона и других известных ученых, атомно-молекулярная гипотеза элементов. Она рассматривает любой химический элемент как отдельный вид атомов, а простые и сложные вещества, как состоящие, соответственно, из атомов одного или разных видов.
Дальтону же принадлежит в определении атомного веса элемента, как важнейшего показателя, от которого напрямую зависят его . Другой химик – Берцелиус - провел большую работу по определению атомных весов элементов. Это во многом способствовало открытию Периодического закона Менделеевым. К этому моменту, было известно 63 элемента. С помощью Периодического закона, стало возможным предсказывать физико-химические свойства еще не открытых элементов.
Каждому элементу в Таблице Менделеева отведено строго определенное место. Он имеет как полное название, так и сокращенную форму записи – символ, состоящий из одной или двух латинских букв, взятых из латинского же названия элемента. Например, Fe (ferrum, железо), Сu (сuprum, медь), Н (hydrogenium, водород). Возле символа элемента располагается следующая информация о нем: порядковый номер, соответствующий количеству протонов в ядре, атомная масса, распределение электронов по энергетическим уровням, электронная конфигурация.
Видео по теме
Абсолютно все, что нас окружает, облака, лес или новенький автомобиль, состоит из чередования мельчайших атомов. Атомы отличаются размером, массой, сложностью строения. Даже принадлежащие к одному виду, атомы могут незначительно различаться. Чтобы навести порядок во всем этом многообразии, ученые придумали такое понятие, как химический элемент. Этим термином принято обозначать постоянное соединение атомов с одинаковым количеством протонов, то есть с постоянным зарядом ядра.
Во время любого возможного взаимодействия между собой атомы химических элементов не изменяются, трансформируются только связи между ними. Например, если на кухне привычным жестом зажечь газовую конфорку, произойдет химическая реакция между элементами. При этом метан (СН4) вступает в реакцию с кислородом (О2), образуя диоксид углерода (СО2) и воду, точнее, водяной пар (Н2О). Но во время этого взаимодействия не было образовано ни одного нового химического элемента, а вот связи между ними изменились.
Систематизация элементов

Впервые идея о существовании постоянных, не изменяющихся химических элементов возникла у знаменитого противника алхимии Роберта Бойля в далеком 1668 году. В своей книге он рассматривал свойства всего 15 элементов, но допускал существование, новых, еще не открытых учеными.
Примерно через 100 лет гениальный химик из Франции, Антуан Лавуазье, создал и опубликован перечень уже из 35 элементов. Правда, не все из них оказались неделимыми, но это запустило процесс поиска, в который включились ученые всей Европы. Среди задач было не только распознавание постоянных атомных соединений, но и возможная систематизация уже определенных элементов.
Впервые о возможной связи между атомной массой элементов и их расположением задумался гениальный русский ученый Дмитрий Иванович Менделеев. Гипотеза занимала его долгое время, но логичную строгую последовательность расположения известных элементов создать не получалось. Основную идею своего открытия Менделеев представил в 1869 году в докладе Русскому химическому обществу, но наглядно продемонстрировать свои выводы он тогда не смог.
Существует легенда, что ученый в течение трех суток кропотливо работал над созданием таблицы, не отвлекаясь даже на сон и еду. Не выдержав напряжения, ученый задремал и именно во сне увидел систематизированную таблицу, в которой элементы заняли свои места согласно своей атомной массе. Конечно, легенда о сне звучит очень увлекательно, но Менделеев размышлял над своей гипотезой больше двадцати лет, поэтому и результат получился настолько исключительным.
Открытие новых элементов

Работу над природой химических элементов Дмитрий Менделеев продолжал и после признания своего открытия. Он смог доказать, что существует прямая зависимость между расположением элемента в системе и совокупности его свойств в сравнении с другими типами элементов. В далеком XVII веке он смог предсказать скорое открытие новых элементов, для которых предусмотрительно оставил пустые клеточки в своей таблице.
Гений оказался прав, вскоре последовали новые открытия, за недолгие семьдесят лет были обнаружены еще девять новых элементов, среди которых легкие металлы галлий (Ga) и скандий (Sc), плотный металл рений (Re), полупроводник германий (Ge) и опасный радиоактивный полоний (Po). Кстати, в 1900 году было принято решение о внесении в таблицу инертных газов, которые имеют низкую химическую активность и почти не вступают в реакцию с другими элементами. Их принято называть нулевыми элементами.
Исследование и поиск новых стабильных соединений атомов продолжалось и сейчас в перечне насчитывается 117 химических элементов. Однако происхождение их отличается, только 94 из них были обнаружены в естественной природе, а остальные 23 новых вещества были синтезированы учеными в ходе изучения процессов ядерных реакций. Большинство этих искусственно полученных соединений быстро распадаются на более простые соединения. Поэтому их считают нестабильными химическими элементами и в таблице для них указывают не относительную атомную массу, а массовое число.
У каждого химического элемента есть собственное уникальное название, состоящее из одной или нескольких букв его латинского наименования. Во всех странах мира принята единые правила и символы описания элемента, у каждого обозначено его место и порядковый номер в таблице.
Распространение в космосе

Специалистам современной науки известно, что количество и распределение одних и тех же элементов на планете Земля и в просторах Вселенной очень отличается.
Так, в космосе самыми часто встречающимися соединениями атомов являются водород (H) и гелий (He). В недрах не только далеких звезд, но и нашего светила, идут постоянные термоядерные реакции с участием водорода. Под воздействием немыслимо высоких температур четыре ядра водорода сливаются, образуя гелий. Так из самых простых элементов получаются более сложные. Высвобождающаяся при этом энергия выбрасывается в открытый космос. Все обитатели нашей планеты ощущают эту энергию как свет и тепло солнечных лучей.
Ученые с помощью метода спектрального анализа выяснили, что Солнце на 75% состоит из водорода, на 24 % из гелия и только оставшийся 1% всей огромной массы звезды содержит другие элементы. Также огромное количество молекулярного и атомного водорода рассеяны в кажущемся пустым космическом пространстве.
В составе планет, комет и астероидов обнаруживают кислород, углерод, азот, серу и другие легкие элементы. Часто встречается конечный продукт "жизни" большинства звезд, привычное нам железо. Ведь, как только ядро звезды начинает синтезировать этот элемент, она обречена. Ученые смогли найти в космосе огромное количество лития, причины появления которого до сих пор не изучены. Намного реже встречаются следы таких металлов как золото и титан, они образовываются только при взрывах очень массивных звезд.
А как на нашей планете

На каменистых планетах, подобных Земле, распространение химических элементов совсем другое. Причем они не находятся в статичном состоянии, а постоянно взаимодействуют между собой. Например, на Земле большое количество растворенных газов переносится водами Мирового океана, а живые организмы и их жизнедеятельность привели к значительному увеличению количества кислорода. Путем длительных расчетов ученые определили, что именно этот необходимый для жизни элемент составляет 50% всех веществ на планете. Неудивительно, ведь он входит в состав многих горных пород, соленой и пресной воды, атмосферы и клеток живых организмов. Каждая живая клетка любого создания почти на 65% состоит из кислорода.
На втором месте по распространенности находится кремний, который занимает 25 % всей земной коры. Его невозможно найти в чистом виде, зато в разных пропорциях этот элемент входит в состав всех имеющихся на Земле соединений. А вот водорода, которого так много в космическом пространстве, в земной коре очень мало, всего 0,9 %. В воде его содержание незначительно больше, почти 12 %.
Химический состав атмосферы, коры и ядра нашей планеты довольно разный, например, железо и никель сосредоточены в основном в расплавленном ядре, а основная часть легких газов постоянно находится в атмосфере или воде.
Реже всего на Земле встречается лютеций (Lu), редкий тяжелый элемент, доля которого составляет всего 0,00008 % массы земной коры. Его открыли в 1907 году, но практического применения этот самый тугоплавкий элемент пока не получил.
Источники:
- Энциклопедия "Кругосвет" Статья "Элементы химические"
В химических реакциях происходят превращения одних веществ в другие. Чтобы понять, как это происходит, нужно вспомнить из курса природоведения и физики, что вещества состоят из атомов. Существует ограниченное число видов атомов. Атомы могут различным образом соединяться друг с другом. Как при складывании букв алфавита образуются сотни тысяч разных слов, так из одних и тех же атомов образуются молекулы или кристаллы разных веществ. Атомы могут образовать молекулы – мельчайшие частицы вещества, которые сохраняют его свойства. Известно, например, несколько веществ, образованных всего из двух видов атомов – атомов кислорода и атомов водорода, но разными видами молекул. К числу таких веществ относятся вода, водород и кислород. Молекула воды состоит из трех частиц, связанных друг с другом. Это и есть атомы. К атому кислорода (атомы кислорода обозначаются в химии буквой О) присоединены два атома водорода (они обозначаются буквой Н). Молекула кислорода состоит из двух атомов кислорода; молекула водорода – из двух атомов водорода. Молекулы могут образовываться в ходе химических превращений, а могут и распадаться. Так, каждая молекула воды распадается на два атома водорода и один атом кислорода. Две молекулы воды образуют вдвое больше атомов водорода и кислорода. Одинаковые атомы связываются попарно в молекулы новых веществ – водород и кислород. Молекулы, таким образом, разрушаются, а атомы сохраняются. Отсюда и произошло слово «атом», что значит в переводе с древнегреческого «неделимый». Атомы – это мельчайшие химически неделимые частицы вещества В химических превращениях образуются другие вещества из тех же атомов, из которых состояли исходные вещества. Как микробы стали доступны наблюдению с изобретением микроскопа, так атомы и молекулы – с изобретением приборов, дающих еще большее увеличение и даже позволяющих атомы и молекулы фотографировать. На таких фотографиях атомы выглядят в виде расплывчатых пятен, а молекулы – в виде сочетания таких пятен. Однако существуют и такие явления, при которых атомы делятся, атомы одного вида превращаются в атомы других видов. При этом получены искусственно и такие атомы, которые в природе не найдены. Но эти явления изучаются не химией, а другой наукой – ядерной физикой. Как уже говорилось, существуют и другие вещества, в состав которых входят атомы водорода и кислорода. Но, независимо от того, входят эти атомы в состав молекул воды, или в состав других веществ – это атомы одного и того же химического элемента. Химический элемент – определенный вид атомов Сколько всего существует видов атомов? На сегодняшний день человеку достоверно известно о существовании 118 видов атомов, то есть 118 химических элементов. Из них в природе встречаются 90 видов атомов, остальные получены искусственно в лабораториях.
Символы химических элементов
В химии для обозначения химических элементов используют химическую символику. Это язык химии . Для понимания речи на любом языке необходимо знать буквы, в химии точно так же. Чтобы понимать и описывать свойства веществ, и изменения, происходящие с ними, прежде всего, необходимо знать символы химических элементов. В эпоху алхимии химических элементов было известно намного меньше, чем сейчас. Алхимики отождествляли их с планетами, различными животными, античными божествами. В настоящее время во всем мире пользуются системой обозначений, введенной шведским химиком Йёнсом Якобом Берцелиусом. В его системе химические элементы обозначают начальной или одной из последующих букв латинского названия данного элемента. Например, элемент серебро обозначается символом – Ag (лат. Argentum). Ниже приведены символы, произношения символов, и названия наиболее распространенных химических элементов. Их нужно заучить на память! Русский химик Дмитрий Иванович Менделеев первым упорядочил разнообразие химических элементов, и на основании открытого им Периодического Закона составил Периодическую Систему химических элементов. Как устроена Периодическая Система химических элементов? На рисунке 58 изображен короткопериодный вариант Периодической Системы. Периодическая Система состоит из вертикальных столбцов и горизонтальных строк. Горизонтальные строки называются периодами. На сегодняшний день все известные элементы размещаются в семи периодах. Периоды обозначают арабскими цифрами от 1 до 7. Периоды 1–3 состоят из одного ряда элементов – их называют малыми. Периоды 4–7 состоят из двух рядов элементов, их называют большими. Вертикальные столбцы Периодической Системы называют группами элементов. Всего групп восемь, и для их обозначения используют римские цифры от I до VIII. Выделяют главные и побочные подгруппы. Периодическая Система – универсальный справочник химика, с ее помощью можно получить информацию о химических элементах. Существует еще один вид Периодической Системы – длиннопериодный. В длиннопериодной форме Периодической Системы элементы сгруппированы иначе, и распределены на 18 групп. В данном варианте Периодической Системы элементы сгруппированы по «семействам», то есть в каждой группе элементов расположены элементы со сходными, похожими свойствами. В данном варианте Периодической Системы , номера групп, как и периодов, обозначают арабскими цифрами. Периодическая Система химических элементов Д.И. Менделеева Характеристики элемента в Периодической СистемеРаспространенность химических элементов в природе
Атомы элементов, встречающихся в природе, распределенные в ней очень неравномерно. В космосе самым распространенным элементом является водород – первый элемент Периодической Системы. На его долю приходится около 93% всех атомов Вселенной. Около 6,9% составляют атомы гелия – второго элемента Периодической Системы. Остальные 0,1% приходится на все остальные элементы. Распространенность химических элементов в земной коре значительно отличается от их распространенности во Вселенной. В земной коре больше всего атомов кислорода и кремния. Вместе с алюминием и железом они формируют основные соединения земной коры. А железо и никель – основные элементы, из которых состоит ядро нашей планеты. Живые организмы также состоят из атомов различных химических элементов. В организме человека больше всего содержится атомов углерода, водорода, кислорода и азота.Делаем выводы из статьи про Химические элементы.
- Химический элемент – определенный вид атомов
- На сегодняшний день человеку достоверно известно о существовании 118 видов атомов, то есть 118 химических элементов. Из них в природе встречаются 90 видов атомов, остальные – получены искусственно в лабораториях
- Существует два варианта Периодической Системы химических элементов Д.И. Менделеева – короткопериодный и длиннопериодный
- Современная химическая символика образована от латинских названий химических элементов
- Периоды – горизонтальные строки Периодической Системы. Периоды разделяют на малые и большие
- Группы – вертикальные строки периодической таблицы. Группы разделяют на главные и побочные